SV2 chap 3 partie 2 (PDF)
File information
Title: SV2 chap 3 partie 2
This PDF 1.3 document has been generated by Pages / Mac OS X 10.13.4 Quartz PDFContext, and has been sent on pdf-archive.com on 02/05/2018 at 16:00, from IP address 109.129.x.x.
The current document download page has been viewed 1162 times.
File size: 10.35 MB (8 pages).
Privacy: public file




File preview
Pierre Cnockaert 2017-2018
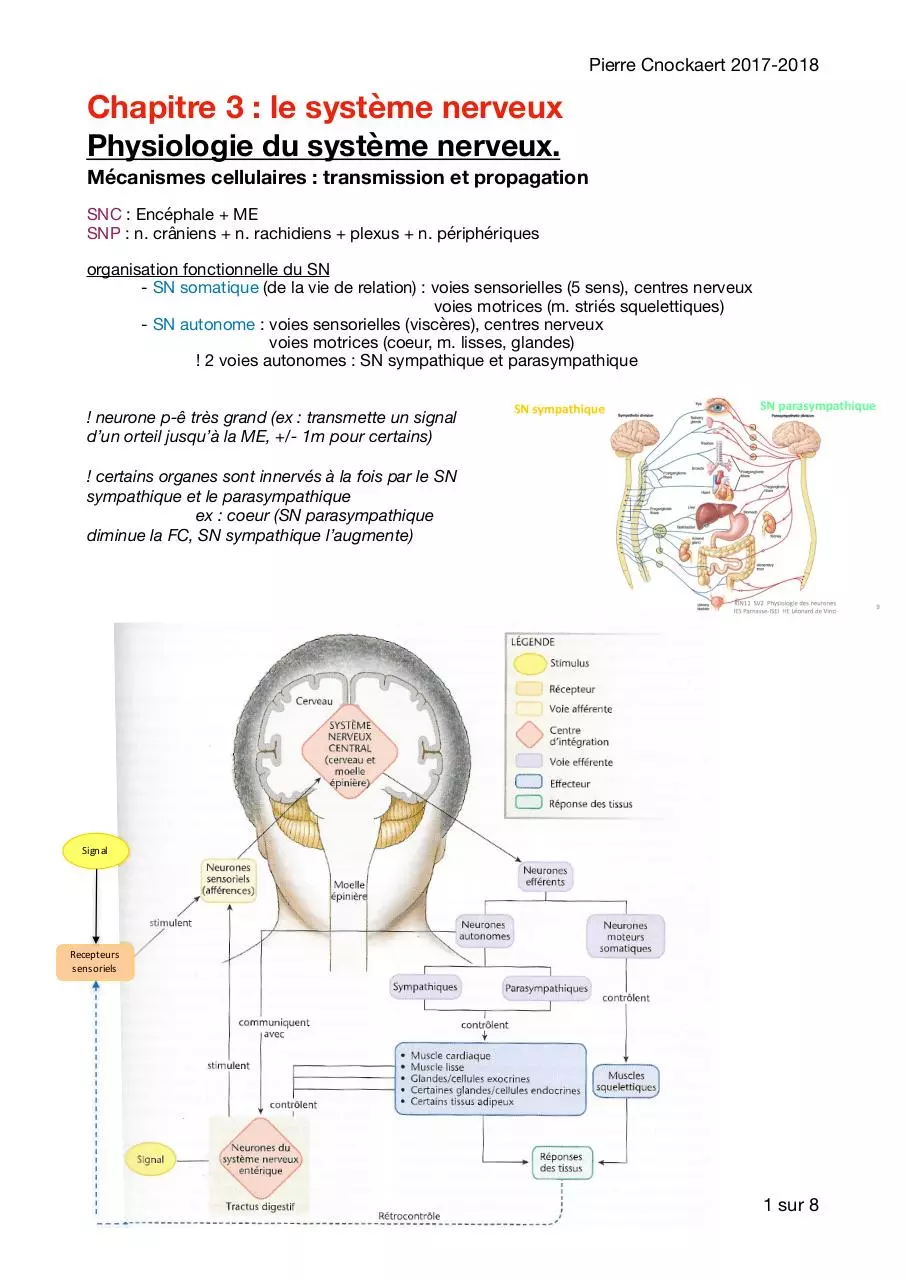
Chapitre 3 : le système nerveux
Physiologie du système nerveux.
Mécanismes cellulaires : transmission et propagation
SNC : Encéphale + ME
SNP : n. crâniens + n. rachidiens + plexus + n. périphériques
organisation fonctionnelle du SN
- SN somatique (de la vie de relation) : voies sensorielles (5 sens), centres nerveux
voies motrices (m. striés squelettiques)
- SN autonome : voies sensorielles (viscères), centres nerveux
voies motrices (coeur, m. lisses, glandes)
! 2 voies autonomes : SN sympathique et parasympathique
! neurone p-ê très grand (ex : transmette un signal
d’un orteil jusqu’à la ME, +/- 1m pour certains)
! certains organes sont innervés à la fois par le SN
sympathique et le parasympathique
ex : coeur (SN parasympathique
diminue la FC, SN sympathique l’augmente)
Signal
Recepteurs
sensoriels
1 sur 8
Pierre Cnockaert 2017-2018
Mouvements ioniques transmembranaires
Quels ions? Na⁺, K⁺, Ca²⁺, Cl⁻
Comment les ions traversent-ils la membrane? via
canaux ou pompes
Par quel mécanisme? - diffusion (gradient de ct°)
- attirance électrique (charge +
attire charge - )
- pompage (voir photo)
! certains canaux sont constamment ouverts (canaux de
fuite) et certains sont voltage-dépendants
! les déplacements d’ions impliquent déplacement de charges électriques, ce qui peut entrainer
l’apparition de potentiels électriques
Potentiels d’équilibre
Equilibre électrochimique atteint
quand force électromotrice (générée par la
ddp électrique de part et d’autre de la
paroi) = force de diffusion (générée par le
gradient de ct° ionique)
=> potentiel d’équilibre ionique (E)
il existe un E pour chaque ion (à
condition que la membrane ne soit
perméable qu’à cet ion), calculable par
l’équation de Nernst (en mV)
Origin of the membrane potential in a purely K+permeable membrane. The porous membrane
separates unequal concentrations of the dissociated
salt K+A−. In the first “jiffy,” the membrane potential, E,
recorded by the electrodes above is zero and K+
diffuses to the right down the concentration gradient.
The anion A− cannot cross the membrane, so a net
positive charge builds up on the right and a negative
charge on the left. At equilibrium, the membrane
potential, caused by the charge separation, has built
up to the Nernst potential, EK, and the fluxes of K+
become equal in the two directions.
(connaitre où se trouve la ct° principale de chaque ion)
Origine des gradients de concentration
ionique
Rôle de la pompe: faire passer le Na+ en
extracellulaire et faire rentrer le K+ dans la cellule
Utilité de la pompe: permettre à la membrane de
répondre à une stimulation.
Ce qui permet à la pompe de fonctionner: de
l’énergie chimique, rendue disponible grâce à la
réaction d’hydrolyse de l’ATP
Donc pompe indispensable au fonctionnement des
neurones, donc indispensable à la vie
! la pompe Na⁺/K⁺ est électrogénique (= elle
maintien le gradient électrique)
2 sur 8
Pierre Cnockaert 2017-2018
Potentiel membranaire de repos
globalement -70mV pour neurone,
varie de -40 à -90mV selon que la
cellule soit musculaire ou nerveuse
! valeur plus proche d’Ek que d’ENa
—> potentiel d’équilibre de
potassium a un coefficient de
perméabilité (PK⁺) 40x > Sodium, Cl⁻
a un gros coeff aussi mais ne
possède pas de canal de fuite Cl⁻!
PMR = potentiel membranaire de
repos, signifie la ddp électrique
mesurée entre face ext. et face int.
de la membrane d’un neurone
(si mesuré avec 2 électrodes à l’ext, ou 2 à l’int,
aucune ddp)
! le PMR peut se calculer
—> équation de Goldman (en mV)
PMR = somme pondérée des Ek,ENa,..
L’équation de Goldman prend en compte les
différents ions se trouvant en intra et extracellulaire,
leur concentration respective en intra et
extracellulaire et la perméabilité membranaire à
chacun d’eux.
=> PMR déterminé essentiellement par le flux sortant
de K⁺, flux sortant en raison du gradient de ct° en K⁺
Grâce à quoi le flux sortant de K⁺ se maintient-il?
Le K⁺ sort en raison de son gradient de ct°
(et la pompe Na⁺/K⁺ maintient un équilibre)
slide manquante : entre dépolarisation et hyperpolarisation se produit la repolarisation
Application : effet d’une hyperkaliémie (ct° extracellulaire en K⁺) sur le PMR?
—> Ct° K⁺ augmente, PMR devient moins négatif
explication : ct° extracellulaire en K⁺ augmente, donc gradient K⁺intracell/K⁺extracell se réduit,
donc moins de K⁺ (charges +) sortent de la cell via les canaux de fuite,
donc l’intérieur de la cell garde davantage de charges + et se dépolarise
! Si ct° extracellulaire en K⁺ augmente trop, le PMR disparait, or sans PMR aucun influx nerveux
n’est possible (donc aucune réponse à la stimulation)
! les cellules nerveuses sont protégées contre les variations de ct° K⁺ extracellulaires (astrocytes
maintiennent une kaliémie dans les normes
Causes d’une hyperkaliémie?
- apport augmenté de potassium
- excrétion rénale diminuée de potassium (insuffisance rénale, diurétiques d’épargne potassique,
médicaments)
- sortie de potassium de la cellule (destruction cellulaire, acidose métabolique)
Potentiel membranaire au repos :
[K⁺]i > [K⁺]e
et PK⁺ élevée (perméabilité)
3 sur 8
Pierre Cnockaert 2017-2018
Potentiel d’action
injection de courant électrique dans l’axone : le
potentiel de membrane devient transitoirement
positif (valeur proche de ENa⁺)
Potentiel d’action PA : inversion brève du PMR
sous l’effet d’une stimulation
! savoir refaire et légender
dès que stimulation
(réatteinte du PMR)
4 sur 8
Pierre Cnockaert 2017-2018
charges + entrent dans la cell,
provoquant un courant électrique qui
stimule l’ouverture d’autres canaux…
augmentation du PA
Ouverture des CVD K⁺ et fermeture des
canaux Na⁺
= hyperpolarisation
mécanismes responsables du PA
Propriétés du PA d’un neurone
- codage de l’intensité de la stimulation
un stimulus plus intense ne se manifeste pas
par une réponse plus intense, mais par une
augmentation de la fréquence de PA (plus de
PA pour un grand stimulus)
5 sur 8
Pierre Cnockaert 2017-2018
- période réfractaire
elle détermine la fréquence max. des PA
! Période réfractaire absolue (correspond à dépolarisation et repolarisation)
: période pendant laquelle un PA ne peut se produire après un 1er PA)
! Période réfractaire relative (correspond à l’hyperpolarisation) : période
pendant laquelle un 2ème PA pourrait avoir lieu si le stimulus est supérieur
à celui qui a causé le 1er PA
Application :
période réfractaire (totale) d’un neurone A = 1ms
- fréq. max. des PA par seconde? 1000
période réfractaire (totale) d’un neurone B = 2ms
- fréq. max. des PA par seconde? 500
période réfractaire (totale) d’une cellule cardiaque = 300ms
- fréq. max. des PA par seconde? 3,3
! 3,3x60 = s/1 min = FCmax (3200)
- seuil d’excitation et loi du tout ou rien (vont ensemble)
seuil d’excitation = valeur du potentiel de membrane qui, si elle est atteinte, sera obligatoirement
suivie d’un PA
! il est atteint lorsque le flux entrant de Na⁺ égalise le flux
sortant de K⁺ (via canaux de fuite) (à ce moment, les CVD
Na⁺ sont déjà ouverts)
! quand le flux entrant de Na⁺ devient supérieur au flux
sortant de K⁺ : PA
! le flux entrant de Na⁺ est initié par la stimulation et
s’amplifie grâce à la dépolarisation = boucle de
rétroaction positive (le flux entrant de Na⁺ augmente le
nombre de CVD Na⁺ qui s’ouvrent)
loi du tout ou rien = une dépolarisation ne permettant pas d’atteindre le seuil ne donnera pas de
PA, si elle permet d’atteindre le seuil, elle en donnera toujours un
(Perméabilité augmente, fait
encore plus se dépolariser
et activer les CVD Na⁺)
(de membrane via ouverture des CVD Na⁺)
CVD K⁺ s’ouvrent (+lents), augmentation de PK⁺
6 sur 8
Pierre Cnockaert 2017-2018
! l’ouverture des canaux sodiques peut résulter
- d’injection de courant électrique dans le neurone (expérimental)
- du contact de la membrane avec une substance chimique
- d’une déformation de la membrane par un stimulus mécanique (entrée de charges + qui ouvre
les CVD Na⁺, initient le PA etc)
2 façons d’initier un PA : substance chimique
et stim. méca
Applications (déclenchement du PA) : modification du fonctionnement des canaux sodiques
- anesthésie locale : blocage des CVD Na⁺ en position fermée—> aucun PA initié s/fibres
nerveuses sensitives, aucune douleur
- tétrodotoxine : idem, aucun PA initié s/fibres motrices, paralysie
- certains médicaments anti-épileptiques : lié à surstimulation de cellules nerveuses, prolongent
période réfractaire du PA (les canaux sodiques restent inactivés plus longtemps après le PA :
neurones moins excitables : diminution du risque de déclencher une crise d’épilepsie)
7 sur 8
Pierre Cnockaert 2017-2018
8 sur 8
Download SV2 chap 3 partie 2
SV2 chap 3 partie 2.pdf (PDF, 10.35 MB)
Download PDF
Share this file on social networks
Link to this page
Permanent link
Use the permanent link to the download page to share your document on Facebook, Twitter, LinkedIn, or directly with a contact by e-Mail, Messenger, Whatsapp, Line..
Short link
Use the short link to share your document on Twitter or by text message (SMS)
HTML Code
Copy the following HTML code to share your document on a Website or Blog
QR Code to this page

This file has been shared publicly by a user of PDF Archive.
Document ID: 0000763395.